I processi decisionali di una cellula li governa la Matematica!
Introduzione
Le cellule sono piene di una quantità innumerevole di proteine che ne influenzano il comportamento e decidono le azioni da intraprendere: dividersi, muoversi, attivarsi, differenziarsi, riprodursi, morire, eccetera. La concentrazione delle varie proteine è regolata da un numero enorme di reazioni chimiche tutte concatenate tra loro in una rete molto intricata paragonata, a volte, ad una rete stradale o ad internet.
Una caratteristica di questa rete è la presenza di meccanismi di retroazione e di interconnessioni che rendono il sistema da una parte molto complesso e dall'altra molto robusto. In particolare, certi interruttori azionati chimicamente permettono di attivare o disattivare delle reazioni a catena dette cascate proteiche in modo netto. Infatti, una caratteristica di molti sistemi biologici è quella di non mostrare alcuna indecisione nei processi intrapresi e di portarli avanti fino a compimento, anche a dispetto di eventuali mutazioni nelle condizioni al contorno. Per esempio, una cellula o si divide o non si divide. Non può dividersi solo un po'. Pertanto, se ha avviato il processo di suddivisione, lo porta a termine.
Negli ultimi anni, si sta sviluppando un settore di ricerca che studia le proprietà ed il funzionamento di queste reti proteiche per poter individuare, ad esempio, quali siano i punti critici su cui puntare l'attenzione per identificare la cura di una particolare malattia andando a cercare il farmaco più adatto. Un altro esempio è la comprensione di quale sia il percorso che un segnale chimico segue per andare dalla membrana al nucleo - un po' come una macchina che sceglie una strada in città per andare dalla periferia al centro - in modo da capire se sia possibile interferire in qualche modo sul segnale, oppure che cosa succede se si blocca una via di trasduzione del segnale, oppure ancora se ci sono delle strade alternative che possono essere seguite.
Ovviamente, il problema è così complesso che non è possibile trattarlo in poche pagine. Vogliamo però presentare alcuni moduli essenziali di questa rete di reazioni subcellulari che risultano fondamentali e che, nonostante la loro importanza, hanno il vantaggio di poter essere studiati con una Matematica molto semplice. Il compito di queste pagine è quindi quello di presentare in maniera didattica la Matematica che governa questi interruttori molecolari presenti nelle reti proteiche.
Applicazioni della Matematica alla Medicina Una delle più recenti applicazioni è legata alla decodifica del genoma umano, con la conseguente nascita della proteomica e della System Biology che studia, tra l’altro, le cascate proteiche. Con l’inizio dell’era post-genomica, medici e biologi si sono trovati ad avere a disposizione una quantità enorme di dati da comprendere e da mettere in ordine. Hanno quindi dovuto coinvolgere nella loro ricerca esperti di Sistemi complessi, Probabilità, Statistica, Crittografia, Meccanica statistica. Oltre alla System Biology, la Comunità Europea ha identificato uno dei progetti principali da sviluppare nella costruzione del Virtual physiological human ossia di modelli realistici di parti del corpo umano da utilizzare come realtà virtuale. Questi modelli sono in generale utilizzati per lo studio delle malattie più diffuse, croniche e letali, come le malattie del sistema nervoso, del sistema circolatorio, il diabete e la crescita di tumori. |
STABILITÀ E FEEDBACK LOOP
Come punto di partenza, consideriamo una reazione chimica il cui prodotto X sia naturalmente degradato. La variazione della quantità di X è legata al suo tasso di produzione e di perdita:
variazione di X = produzione - perdita
o, in formule:
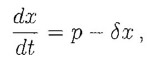
dove con x abbiamo denotato la concentrazione di X.
Molto probabilmente la produzione di X sarà legata alla presenza di altre molecole e quindi p dipenderà dalla loro concentrazione. Per semplicità consideriamone solo una, y. Lo stimolo di produzione di X da parte di Y si può indicare graficamente in questo modo:
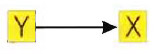
È chiaro che si raggiunge un equilibrio quando il tasso di produzione e di perdita si eguagliano, ossia quando il secondo membro della precedente uguaglianza si annulla:
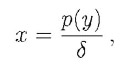
che è possibile riportare in un grafico che rappresenterà la concentrazione di equilibrio di X dipendente dalla concentrazione di Y.
Ora consideriamo il più semplice feedback loop in cui X stimola Y ed Y stimola X:
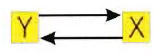
Da un punto di vista qualitativo, è semplice capire perché la presenza di un loop del genere in una cascata proteica possa portare ad una amplificazione del segnale. Infatti, la proteina X promuove la produzione di Y che stimola a sua volta la produzione di nuovo X che stimola ancora di più la produzione di Y e così via. Quindi un meccanismo del genere può portare a quella che si chiama una sovraespressione di entrambe le proteine X ed Y In termini matematici, tutto questo viene espresso dal seguente sistema di equazioni differenziali:
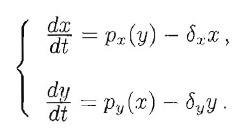
Il luogo dei punti di equilibrio nel piano risolvendo graficamente il sistema:
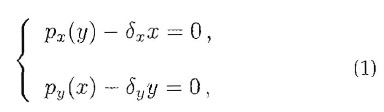
ossia disegnando:
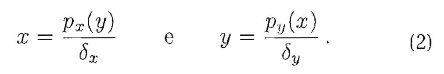
Gli eventuali punti di intersezioni delle due curve rappresenteranno quelle configurazioni in cui entrambe le derivate sono nulle, cioè i punti di equilibrio del sistema differenziale.
Stabilità È il concetto che descrive il comportamento di un sistema nelle vicinanze di una posizione di equilibrio, cioè di una configurazione che, se occupata inizialmente, viene occupata per sempre. Risulta però essenziale, a questo punto, descrivere anche cosa succede quando questa configurazione di equilibrio non viene occupata esattamente o viene perturbata. In tali condizioni, il sistema si evolve mantenendo configurazioni vicine a quella di equilibrio e si dice che questa configurazione di equilibrio è stabile. |
La stabilità di queste posizioni di equilibrio si può determinare andando ad analizzare la matrice jacobiana:
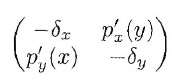
la cui traccia è sempre negativa. Quindi la negatività della parte reale degli autovalori (e quindi la stabilità della configurazione di equilibro) è controllata dalla positività del suo determinante calcolato nella posizione di equilibrio, ossia quando:
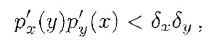
ovvero:
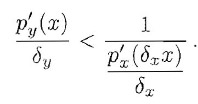
Autovalori e stabilità Gli auto valori di una matrice A sono quei numeri (in genere complessi) tali che Au=Iu. |
Graficamente la condizione di stabilità è verificata quando, nell'intersezione delle due curve, la funzione:
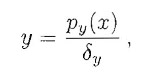
ha derivata minore di quella di:
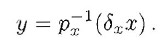
Per essere più specifici, supponiamo che i termini di produzione siano del tipo Michaelis-Menten:
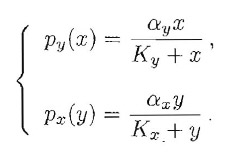
Rappresentando graficamente le due curve di (2), come fatto in Fig.1, si può subito osservare che, se:
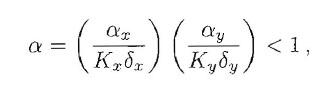
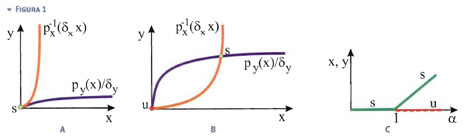
la curva y=py(x)/δy è, esclusa l'origine, sempre al di sotto di y=px-1(δxx). Quindi c'è solo l'intersezione banale x=y=0 che, secondo i criteri appena esposti, è stabile. Se invece è α>1 la soluzione banale diventa instabile ed esiste un'altra intersezione non banale (x, y≠0) che risulta stabile.
La strana combinazione di parametri inclusi nella definizione di α risulta quindi particolarmente importante, discriminando il numero di configurazioni di equilibrio. È utile rappresentare il valore delle posizioni d'equilibrio in funzione di α in un cosiddetto diagramma di biforcazione (Fig.1c). Dal punto di vista descrittivo, questo grafico permette di visualizzare il fatto che, per α<1, il loop di stimolazione non è abbastanza forte ed x e y tendono entrambi a zero. Per α>1, il loop amplifica sia la concentrazione di x che di y.
INTERRUTTORI BIOLOGICI BASATI SU FEEDBACK LOOP POSITIVI
Nei sistemi appena visti, la transizione tra una posizione di equilibrio ed un'altra è morbida. Quando si attraversa il punto di biforcazione α=1, il passaggio dalla configurazione banale a quella non banale non presenta salti. Non c'è uno stato on ed uno stato off, uno stato attivo ed uno stato inattivo tra i quali si salta azionando un "interruttore molecolare". Faremo vedere ora che ciò può succedere se i tassi di produzione p sono dati da leggi di Hill:
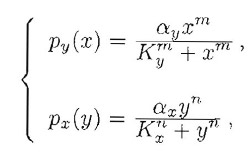
con n,m>1 che implica un più complesso meccanismo enzimatico alla base delle reazioni di produzione. A dir la verità, è sufficiente che solo una delle due reazioni soddisfi una legge di Hill, mentre l'altra potrebbe continuare ad essere del tipo Michaelis-Menten.
In questo caso la determinazione grafica delle posizioni di equilibrio porta all'esistenza di una o tre posizioni di equilibrio, a seconda del valore dei parametri (si veda la Figura 2). Quella banale è sempre stabile. Le altre due, quando esistono, sono una instabile ed una stabile. Il diagramma di biforcazione è riportato in Fig.2c.
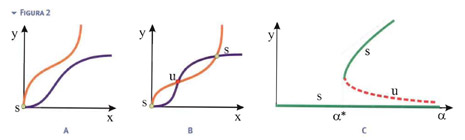
Quindi, per α>α*, si hanno contemporaneamente due posizioni di equilibrio stabile: una in cui il sistema è disattivato e l'altra in cui il sistema è attivato. Un'influenza esterna ad hoc può quindi far saltare il sistema da uno stato all'altro.
Per essere più specifici, si possono determinare le posizioni di equilibrio per n=2 ed m=1. In questo caso, si può provare che la configurazione non banale esiste per α>α*=2 ed è data da:
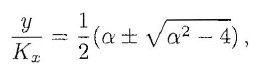
o, in termini di β=1/α:
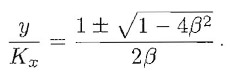
Supponiamo, per esempio, che sia possibile cambiare gradualmente il parametro di biforcazione tramite uno stimolo esterno e supponiamo di partire da uno stato off. Se lo stimolo aumenta ed il corrispondente parametro di biforcazione supera il valore critico α*, una perturbazione nella concentrazione per esempio di Y potrebbe far saltare il sistema nello stato attivo. Il salto necessario è tanto più piccolo quanto più grande è lo stimolo α. Se, viceversa, si parte da uno stato attivo e lo stimolo a diminuisce gradualmente, allora quando a diminuisce al di sotto di α* il sistema si disattiva.
INTERRUTTORI BIOLOGICI BASATI SU FEEDBACK LOOP MUTUAMENTE INIBITORI
Ancora più frequenti all'interno della cellula sono i feedback loop caratterizzati dal fatto che la presenza di X inibisce Y che a sua volta inibisce X. Graficamente, l'azione inibitoria viene indicata con una freccia a blocco:
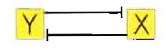
Come in un gioco di guardie e ladri, la presenza di X ostacola la formazione del suo controllore Y, per cui ancora più X vengono prodotti. In linea di principio, è quindi comprensibile come questo meccanismo possa portare ad una amplificazione del segnale con contemporaneo smorzamento del suo inibitore.
Per fare un esempio semplice di un sistema di questo tipo, è utile ricordare che all'interno della cellula molte proteine possono assumere configurazioni diverse, per esempio tramite un processo chiamato fosforillazione che consiste nell'aggiunta di un gruppo fosfato alla molecola. Questo processo reversibile può attivare e disattivare una proteina. È chiaro che, se le proteine si trasformano soltanto ma non vengono prodotte o degradate, la loro quantità totale si conserva. Quindi, se chiamiamo x (rispettivamente y) la concentrazione della forma attiva di X (rispettivamente Y), la concentrazione della sua forma inattiva sarà X-x (rispettivamente Y-y) con X ed Y costanti, che denotano le concentrazioni totali di X e di Y. Possiamo per esempio scrivere:
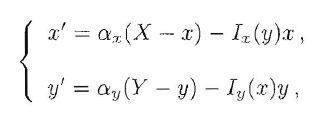
con la quale indichiamo che, per esempio, la concentrazione di molecole attive di X cresce per attivazione delle molecole inattive di X e decresce per l'effetto inibitorio della forma attiva della proteina Y.
Le configurazioni di equilibrio sono identificate dalle intersezioni delle due curve:
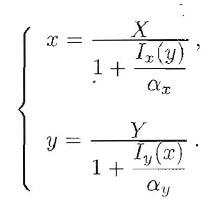
Se le reazioni di inibizione sono del tipo MichaelisMenten, si può facilmente vedere che le curve hanno una sola intersezione e questa, sulla base di argomenti simili a quelli svolti finora, risulta essere una configurazione di equilibrio stabile per il sistema. Se invece le reazioni di inibizione rispondono ad una legge di Hill, la situazione è più complessa: ci possono essere una o tre intersezioni a seconda dei parametri, dando luogo al fenomeno di bistabilità, cioè alla presenza di due posizioni di equilibrio stabile per lo stesso valore del parametro di biforcazione. A dir la verità, basta che una sola delle reazioni enzimatiche risponda ad una legge di Hill.
Per fare un esempio specifico supponiamo:
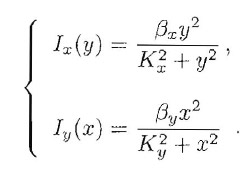
Facendo riferimento alla Fig.3, possiamo immaginare che i parametri nella prima equazione siano fissi, mentre quelli della seconda possano variare (per esempio, la quantità Y di proteine a disposizione o il rapporto β= βy/αy).
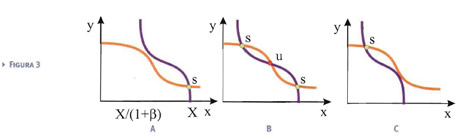
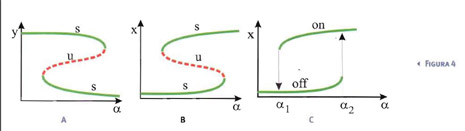
Supponiamo, per esempio, che sia possibile cambiare gradualmente il parametro di biforcazione tramite uno stimolo esterno e supponiamo di partire da uno stato off per X. Se lo stimolo aumenta ed il corrispondente parametro di biforcazione supera il valore critico α2, il sistema deve passare dallo stato off allo stato on in cui permane, a meno che lo stimolo non decresca al di sotto di un valore per cui il parametro di biforcazione diventa minore di α1. In questo caso, il sistema ritorna nello stato off, pronto a riattivarsi di nuovo quando verrà stimolato. Una volta attivato, piccole variazioni dello stimolo fanno rimanere il sistema nello stato attivo. Servono variazioni sensibili per far cambiare stato al sistema.
Se lo stimolo varia ciclicamente, si può quindi instaurare un ciclo di isteresi.
Angeli, Ferrell e Sontag (PNAS, vol. 101, pp.1822-1827, 2004) suggeriscono di studiare il sistema, spezzando questi loop:
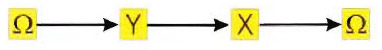
osservando, solo alla fine, che quell'Ω che inizialmente aveva stimolato X era proprio Y. Dal punto di vista operativo, questo vuol dire risolvere:
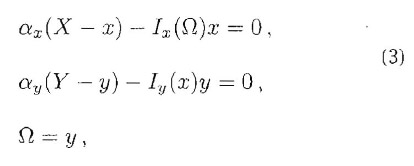
invece del sistema equivalente ottenuto ponendo uguale a 0 il secondo membro del sistema (3). Anzi, dalla prima equazione si può determinare x in funzione di Ω, sostituirlo nella seconda e determinare in cascata y in funzione di Ω. La soluzione del sistema si ottiene graficamente intersecando il grafico di:
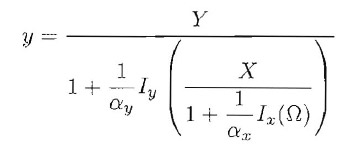
con la retta y=Ω. Questo metodo risulta molto efficace nello studio di loop più complessi o di cascate proteiche più lunghe.
DIFFERENZIAZIONE CELLULARE E CICLI CELLULARI
Vedremo ora come i feedback loop appena citati abbiano la potenzialità di convertire uno stimolo transitorio in una risposta irreversibile. In tal senso, possono quindi rappresentare il meccanismo utilizzato dalle cellule per intraprendere una via senza ritorno (per esempio dividersi, attivare il meccanismo di suicidio, differenziarsi da uovo immaturo a uovo maturo o da cellula staminale in cellula di altro tipo).
Consideriamo un sistema molto semplice in cui la proteina è fosforillata, e quindi attivata tramite uno stimolo α, e la forma fosforillata stimola ulteriore fosforillazione di X.
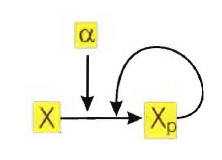
Il meccanismo può essere rappresentato dall'equazione differenziale:
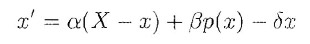
dove p(x) rappresenta una reazione di tipo Hill e δ rappresenta il tasso di deattivazione (non rappresentato nello schema).
Il diagramma di biforcazione può essere ottenuto facilmente calcolando α in funzione della risposta x. Si avrà bistabilità quando la funzione α(x) non è monotona, ma presenta massimi e minimi. I punti di massimo e minimo rappresentano gli estremi dell'intervallo di bistabilità. Aumentando la "forza" β del feedback, si ha quindi la comparsa della regione di bistabilità (Fig.5b). Può ora succedere che l'intervallo di bistabilità includa una parte fisicamente non ammissibile (nel caso specifico, stimoli negativi). La descrizione è quindi la seguente. Facendo riferimento alla Fig.5c, se lo stimolo aumenta al di sopra di α2, il sistema salta allo stato on.
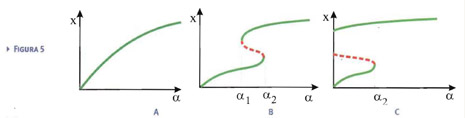
A questo punto, se anche lo stimolo venisse a cessare, il sistema rimarrebbe nello stato differenziato, che quindi diventerebbe permanente.
Naturalmente, abbiamo mostrato solamente i loop più semplici. Ci possono essere loop più complicati, da cui ci si può aspettare fenomeni simili, come in Fig.6. Se i loop sono logicamente coerenti, allora con un ragionamento di tipo booleano è facile capire che cosa è sovraespresso e che cosa è sottoespresso.
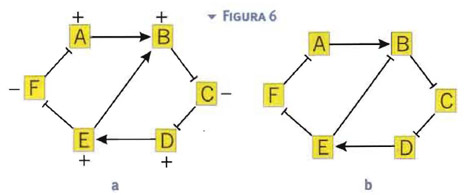
Basta partire da una proteina ed assegnarle un +, far conservare il segno in corrispondenza di una freccia normale e cambiare il segno in corrispondenza di un freccia a blocco.
Purtroppo questo non è sempre possibile come, per esempio, viene mostrato in Fig.6b. Anche questo meccanismo riveste la sua importanza. Sembra che loop del genere siano alla base dei fenomeni ciclici, quali la definizione dell'orologio biologico e del ciclo cellulare e la produzione periodica di opportune proteine. Facendo riferimento alla Fig.6b, il meccanismo si può semplicemente descrivere in questo modo. All'attivazione di A, corrisponde l'attivazione di B che inibisce C, che non controlla più la produzione di D che quindi aumenta ed attiva E. L'attivazione di E però contribuisce a disattivare B, che era attivo. Proseguendo nel percorso, questo comporterà una disattivazione di E ed una nuova attivazione di B. È quindi come se, all'interno della cellula, ci fosse qualcuno che accendesse e spegnesse periodicamente gli interruttori.
BIBLIOGRAFIA ESSENZIALE
- Angeli D., Sontag E. D., "Monotone control systems" in IEEE Trans. Autom. Control 48(2003), pp. 1684-1698.
- Angeli D., Ferrell J.E., Sontag E.D., "Detection of multistability, bifurcations, and hysteresis in a large class of biological positive-feedback systems" in PNAS 101(2004), pp. 1822-1827.
- Bhalla U.S., lyengar R., "Emergent properties of networks of biologica[ signaling pathways" in Science 283 (1999), PP. 381-387.
- Bhalla U. S., lyengar R., "Functional modules in biological signalling networks" in Novartis Found. Symp. 239 (2001), PP. 4-13.
- Ferrell J. E. Jr., Machleder E. M., "The biochemical basis of an all-or-none cell fate switch in Xenopus oocytes" in Science 280 (1998), pp. 895-898.
- Ferrell J. E. Jr., Xiong W., "Bistability in cell signaling: how to make continuous processes discontinuous, and reversible processes irreversible" in Chaos 11(2001), pp. 227-236.
- Kholodenko B. N., "Negative feedback and ultrasensitivity can bring about oscillations in the mitogen-activated protein kinase cascades" in Eur. /. Biochem. 267 (2000), pp. 1583-1588.
- Novak B., Tyson J. J., "Numerical analysis of a comprehensive model of M-phase control in Xenopus oocyte extracts and intact embryos" in J. Cell Sci. 106(1993), pp. 1153-1168.
