La Matematica nel sangue
I fatti
Tutti abbiamo un po’ di Matematica nel sangue, almeno all’inizio. Una legge matematica sembra infatti governare fin dalla fase embrionale lo sviluppo e l’organizzazione dei vasi sanguigni che trasportano il sangue e quindi l’ossigeno e le sostanze nutritive a tutti gli organi del nostro corpo. I vasi sanguigni compongono una rete di tubi di dimensioni diverse, la rete vascolare: le grosse vene e arterie si ramificano in tubicini di diametro sempre più piccolo, fino ai piccolissimi capillari.
Il primo abbozzo di rete vascolare si crea nell'embrione, dove alcune cellule embrionali si specializzano e formano i primi vasi capillari. Tutta la rete vascolare del nostro corpo deriva dall'espansione e dal rimodellamento di questa primitiva rete embrionale, grazie alla moltiplicazione e all'accrescimento dei vasi esistenti.
Tutti i vasi sanguigni sono costituiti da cellule endoteliali. A seconda del diametro e della funzione del vaso, la parete può o meno essere rivestita esternamente da altri tessuti (muscolare e connettivo). I capillari sono così sottili che la loro parete è formata esclusivamente da una sola cellula endoteliale raccolta su se stessa a forma di ciambella.
Figura 1. Reti di capillari in vitro
Uno dei modelli sperimentali usati per studiare la formazione della rete di capillari in vitro è costituito da una coltura di cellule endoteliali umane versate sopra un substrato gelatinoso, chiamato Matrigel, che riproduce verosimilmente l'ambiente extracellulare dei tessuti viventi. Le cellule si depositano a caso sulla superficie del substrato e vengono osservate al microscopio: si muovono e si organizzano formando spontaneamente una rete di vasi capillari del tutto simile alle reti capillari dei tessuti in vivo (Figura 1). Le cellule si ripiegano in modo da formare il lume del capillare. Naturalmente, i capillari che nascono in una coltura di cellule endoteliali non contengono sangue e non trasportano nulla. Il flusso sanguigno non è quindi necessario per la formazione della rete: le cellule si organizzano autonomamente e non richiedono stimoli esterni ad esse.
Figura 2. Modello di distribuzione delle galassie
È interessante notare che altre strutture simili alle reti di capillari si trovano sia in natura sia in alcuni problemi matematici. In astrofisica, per esempio, la distribuzione delle galassie nell’Universo e’ organizzata a rete (Figura 2), secondo il modello sviluppato da Zeldovich partendo da una distribuzione iniziale casuale delle masse.
Figura 3. Tassellazione di Voronoi
La Figura 3 invece mostra il problema matematico della “tassellazione di Voronoi” in cui, dato un insieme N di punti distribuiti casualmente su un piano, si costruiscono dei poligoni tali che i punti appartenenti ad ogni poligono sono i più vicini all’unico punto dell’ insieme N che si trova all’interno del poligono stesso. I poligoni ottenuti formano una struttura a rete.
Rispetto agli esempi precedenti la rete dei capillari ha però una caratteristica geometrica e funzionale specifica. È composta da "nodi" separati da una distanza caratteristica detta "corda", che rappresenta la dimensione tipica della rete. Negli esperimenti in vitro, le cellule endoteliali formano reti la cui corda misura circa 200µm. Le reti di capillari in vivo hanno corde comprese tra 50 e 300 µm, valori ottimali per gli scambi metabolici: valori maggiori manterrebbero i capillari troppo lontani dalle cellule interne del tessuto che devono nutrire, mentre valori minori costituirebbero uno spreco inutile.
Le domande
Come possono le cellule endoteliali organizzarsi geometricamente per formare i vasi? Qual è il meccanismo che regola la dimensione della rete di capillari?
Le risposte a queste domande sono di grande interesse non solo scientifico, ma anche medico e terapeutico. In particolare la formazione di una rete vascolare efficiente è un obiettivo primario delle tecniche di ingegneria tissutale, che creano o modificano in laboratorio tessuti umani per sostituire tessuti malati o danneggiati: i capillari devono essere strutturati in modo da distribuire i nutrienti a tutte le cellule del tessuto, che altrimenti morirebbero. Anche la crescita di un tumore solido è limitata dal rifornimento di sangue. Inizialmente, il tumore non è vascolarizzato e può crescere fino ad un diametro di circa 2mm, grazie alla semplice diffusione dell'ossigeno e dei nutrienti tra le cellule tumorali. L'aumento di dimensioni e l'aggressività del tumore dipendono dall'organizzazione di una rete di capillari che invade la massa tumorale raggiungendone anche le cellule più interne. Le cellule endoteliali sono quindi un bersaglio importante della terapia antitumorale: capire come si forma la rete vascolare del tumore può aiutare a bloccarne la progressione.
Dal modello sperimentale al modello matematico
Il primo passo nello sviluppo di un modello matematico per la formazione della rete di capillari è stata la ricerca dei fattori che stimolano e governano il moto delle cellule.
La nascita della rete è stata osservata al microscopio e filmata: le cellule endoteliali si muovono in direzioni diverse, interagiscono le une con le altre, aderiscono al substrato e alle cellule vicine tentando di formare una rete multicellulare connessa. Inizialmente, le cellule si muovono a caso. Quando però scelgono una direzione verso cui muoversi, mostrano una certa persistenza nel mantenerla, o forse meglio, una resistenza a cambiare la direzione del moto, perchè ciò dal punto di vista biologico richiede alla cellula una riorganizzazione interna. Inoltre, le cellule tendono a muoversi verso zone in cui la densità di cellule è maggiore (va ricordato che la distribuzione iniziale delle cellule sul Matrigel è casuale e disomogenea, e cioè genera zone a maggiore o a minore densità).
Esiste inoltre una molecola (VEGF) che attrae le cellule e che e’ prodotta dalle cellule stesse. Dove la densità di cellule è maggiore, è anche maggiore la concentrazione della molecola: ne consegue che le cellule si attraggono fra loro.
Per verificare questa ipotesi è stato ricostruito al calcolatore il campo di concentrazione del chemioattrattore, supponendo che la molecola sia secreta da ogni cellula, diffonda intorno ad essa e si degradi spontaneamente nel tempo. Si trova che le traiettorie cellulari sono dirette effettivamente verso le zone con maggiore concentrazione simulata di chemioattrattore (Figura 4).
Figura 4. Traiettoria di una cellula nel campo simulato di concentrazione del fattore chimico.
Altre considerazioni importanti per lo sviluppo del modello matematico sono le seguenti:
- le cellule non muoiono, né si moltiplicano durante la formazione della rete;
- le cellule non possono compenetrarsi una nell'altra;
- la popolazione di cellule può essere descritta dal punto di vista fisico come un sistema continuo;
- il sistema può quindi essere descritto analizzando l’evoluzione temporale della densità n e della velocità v su un piano;
- l’evoluzione dipende dalla concentrazione c del VEGF in un dato punto;
- il movimento delle cellule è rallentato dall'attrito dovuto all'interazione con il substrato su cui si muovono.
Tutte le osservazioni e le ipotesi sono tradotte in tre equazioni:
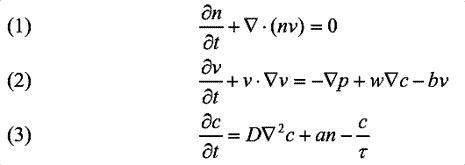
L'equazione (1) descrive la conservazione della massa durante la formazione della rete, cioè rende conto del fatto che le cellule non muoiono né si moltiplicano. La (3) descrive come varia la concentrazione del chemioattrattore nel tempo, in funzione della velocità di rilascio, di diffusione e di degradazione di questa molecola. La (2) descrive la risposta delle cellule alle diverse forze che agiscono su di esse. Queste forze sono:
- una forza chemiotattica che attrae le cellule verso le zone con maggior concentrazione di chemioattrattore e quindi con maggior densità cellulare;
- una forza dissipativa che rallenta le cellule, dovuta all'interazione col Matrigel;
- una forza repulsiva che impedisce alle cellule di ammassarsi, dovuta all'impossibilità delle cellule di compenetrarsi.
Dal modello matematico alle caratteristiche qualitative della soluzione
Le equazioni (1-3) costituiscono il modello matematico della formazione della rete di capillari.
Esse permettono di prevedere alcune proprietà del fenomeno biologico verificabili sperimentalmente, confermando così la validità del modello stesso.
Ad esempio, dalle tre equazioni si può ricavare la lunghezza della corda tra i nodi della rete. Si trova così che tale lunghezza dipende dal coefficiente D di diffusione della molecola e dal suo tempo di dimezzamento t, secondo la relazione L=(Dt)1/2.
Il coefficiente di diffusione D è una misura della velocità di diffusione della molecola. Il tempo di dimezzamento t è il tempo occorrente per ridurre alla metà una certa concentrazione di VEGF-A a causa della sua spontanea degradazione. Sia D che t possono essere misurati sperimentalmente e quindi si può calcolare L.
Figura 5. Simulazione con 200 cellule/mm2
Si trova che L è dell’ordine di 100 µm. Questo valore è quindi compatibile con le misure sperimentali effettuate in vitro, dove L è circa 200 µm. Il risultato conferma la validità del modello e delle ipotesi su cui si basa (si confrontino le Figure 5 ed 1).
La relazione L=(Dt)1/2 fornisce un legame diretto tra la dimensione della rete, data da L, e la distanza di interazione tra le cellule mediata dal chemioattrattore. Inizialmente le cellule si distribuiscono a caso sul Matrigel. Ci sono delle disomogeneità casuali nella densità delle cellule corrispondenti a disomogeneità nella concentrazione di chemioattrattore. Il movimento chemiotattico delle cellule amplifica queste disomogeneità: si creano picchi di concentrazione separati da zone con concentrazione minima. La distanza tra i punti di massimo e di minimo è L.
Si forma così una rete i cui nodi sono separati da una corda di lunghezza caratteristica L.
Dal modello matematico alla simulazione numerica
È interessante confrontare le fotografie delle strutture formate dalle cellule a densità diverse con le immagini ottenute dalla simulazione numerica inserendo nel modello matematico gli stessi valori di n (le figure 6, 5 e 7 sono ottenute per valori crescenti di cellule utilizzate). Queste immagini costituiscono delle simulazioni del comportamento delle cellule. Se n è troppo basso come in Figura 6, la rete non si forma, se è troppo alto come in Figura 7 si crea una struttura simile ad un tappeto con buchi. La rete di capillari si forma correttamente solo se la densità delle cellule è compresa tra 100 e 300 cellule/mm2. La corrispondenza tra le simulazioni e gli esperimenti è notevole.
Al variare della densità di cellule non esiste un passaggio graduale dalla struttura corretta, a rete, verso quella non funzionale. Un cambiamento improvviso nelle proprietà di una struttura formata casualmente, dovuto alla variazione di un parametro fondamentale (qui n), è noto in Fisica come transizione percolativa. Questo fenomeno conferma l'importanza della densità di cellule nel processo di formazione della rete di capillari. Esistono situazioni patologiche osservate in animali da esperimento in cui un sovraffollamento di cellule endoteliali è la causa di una grave disorganizzazione della rete vascolare. Anche la transizione percolativa viene osservata sperimentalmente e riprodotta dalle simulazioni.
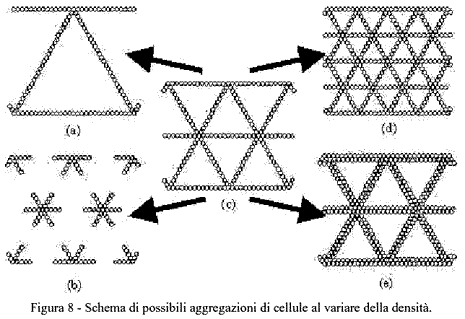
L'esistenza di una transizione percolativa a basse densità e della formazione di lacune ad alte densità sembrano essere legate entrambe alla tendenza del sistema fisiologico a mantenere per quanto possibile la dimensione caratteristica delle strutture, piuttosto che a raggiungere una distribuzione il più uniforme possibile. Infatti, se la densità di cellule si discosta troppo da quella ottimale, teoricamente sono possibili due diverse distribuzioni delle cellule stesse, come è illustrato dalle due righe in Figura 8. Se la dimensione della rete può variare, diminuendo il numero di cellule le cellule per mantenere la connessione si possono distribuire in modo da ingrandire le maglie della rete (Figura 8a); se invece la lunghezza della corda deve rimanere costante, si ha la distribuzione in Figura 8b, dove la struttura perde il suo carattere di connessione perchè il numero di cellule è insufficiente. Questo secondo caso è quello previsto dal modello matematico e che avviene in natura, perchè la dimensione della rete è quella ottimale dal punto di vista fisiologico. Per un motivo molto simile, se si raddoppia il numero di cellule a partire dallo schema di partenza, nella situazione della Figura 8d dove la lunghezza delle corde cambia si crea una rete uniforme e più fitta di quella di partenza, mentre nella schematizzazione corrispondente alla Figura 8e si ha una struttura che, mantenendo le grandezze caratteristiche, tende ad inspessire le corde, fino a raggiungere la formazione di lacune quando si raddoppia ancora il numero di cellule (non illustrato).
Abbiamo voluto descrivere un modello matematico che è risultato utile a gettar luce sui meccanismi della nascita della rete vascolare tramite la descrizione delle caratteristiche qualitative della soluzione ed i risultati della simulazione numerica. Ma questo è solo un esempio. Chissà quanta Matematica c’è all’interno del nostro corpo umano.
Bibliografia
[1] Ya. B. Zeldovich, A.A. Ruzmaikin, D.D. Sokoloff (1990) The Almighty Chance, World Scientific, Singapore.
[2] G. Serini, D. Ambrosi, E. Giraudo, A. Gamba, L. Preziosi, F. Bussolino (2003) Modeling the early stages of vascular network assembly, The EMBO Journal 22, pp.1771-1779.
[3] A. Gamba, D. Ambrosi, A. Coniglio, A. de Candia, S. Di Talia, E. Giraudo, G. Serini, L. Preziosi, F. Bussolino (2003) Percolation, morphogenesis, and Burgers dynamics in blood vessel formation, Phys. Rev. Letters 90, pp. 118101.

